
产品货号:
YTB4190
中文名称:
RNA生物素标记试剂盒
英文名称:
Biotin RNA Labeling Kit(SP6/T7)
产品规格:
20T|100T
发货周期:
1~3天
产品价格:
询价
本制品是一种通过高效的SP6 RNA polymerase或T7 RNA polymerase进行体外转录,从而获得生物素标记的RNA探针的试剂盒。本试剂盒可以配合RNA体外转录质粒或其它在多克隆位点两侧有SP6或T7 promoter的质粒,在多克隆位点插入目的基因并线性化后使用。

利用带有SP6 Promoter (ATTTAGGTGACACTATAG)或T7 Promoter (TAATACGACTCACTATAGGG)的线性化质粒、PCR产物或合成的DNA片段等为模板,利用SP6 RNA Polymerase或T7 RNA Polymerase能在相对较短的时间内进行体外RNA转录的特性,以Biotin-16-UTP部分取代UTP,从而转录生成生物素标记的RNA探针。
Biotin-16-UTP是UTP的生物活性类似物,在体外转录反应中很容易被SP6或T7 RNA Polymerase作为转录反应底物整合到RNA中。由于使用的RNA Polymerase对天然核苷酸(NTP)和生物素标记核苷酸(Biotin-NTP)没有选择倾向性,因此每个RNA转录产物生物素标记的程度可以通过调节转录反应中NTP与Biotin-NTP的比例来控制。本试剂盒将Biotin-16-UTP的比例控制在约35%,使反应和标记效率之间达到较好的平衡。

- 使用本试剂盒获得的RNA探针应用范围广。本试剂盒转录合成的带生物素标记的RNA探针可用于Northern、Southern、原位杂交、RNase保护实验等相关研究。
- 本试剂盒标记的RNA探针后续兼容多种检测方法。本试剂盒转录合成的带有生物素标记的RNA探针可以使用荧光基团、酶或抗体偶联的链霉亲和素(Streptavidin)进行检测。推荐使用HRP标记链霉亲和素(YT371或YTC0305)与DAB-HRP显色试剂盒或极超灵敏ECL化学发光试剂盒联合使用进行检测,或者使用碱性磷酸酶标记链霉亲和素与BCIP/NBT碱性磷酸酶显色试剂盒联合使用进行检测。

| 组分 | 20T | 100T |
| Nuclease-free Water | 0.5mL | 2mL |
| 10×NTP Labeling Mix | 40μL | 200μL |
| 10×Transcription Buffer | 40μL | 200μL |
| SP6 Control Template (0.5μg/μL) | 6μL | 20μL |
| T7 Control Template (0.5μg/μL) | 6μL | 20μL |
| SP6 RNA Polymerase | 40μL | 200μL |
| T7 RNA Polymerase | 40μL | 200μL |
| RNase Inhibitor | 10μL | 50μL |
| DNase I | 40μL | 200μL |
保存:-20℃,有效期1年。

- 本试剂盒内所有试剂保存在-20℃,并尽量避免反复冻融。
- 所有试剂使用前请进行快速离心使液体沉降至管底后再开启使用。
- 需要自备的试剂:预冷无水乙醇、预冷70%乙醇、RNA纯化及其它相关的实验试剂耗材。
- 由于涉及RNA操作,请严格按照RNA操作的规范进行,避免RNase污染,相关试剂和耗材需要经过DEPC处理以去除RNase或者确保是RNase free的。
- 本试剂盒的反应体系通常为20μL,但可根据实际需求按比例放大反应体系。
- 建议尽量提高转录模板的质量和纯度,以保证生物素标记RNA的产量。

- 以带有SP6或T7 Promoter的线性化质粒DNA为模板进行转录时的产量参考图1。本试剂盒在标准的RNA转录反应条件下,在20μL的反应体系中,使用1μg的线性化DNA模板(长度约3kb),37℃孵育2小时,转录产物长度约为500nt时,可合成约8~10μg生物素标记的RNA。合成的标记RNA的数量取决于模板DNA的数量、纯度以及转录产物的长度。进一步延长孵育时间并不会增加生物素标记RNA的产量,但可以通过按比例放大反应体系,获得更多的生物素标记RNA。
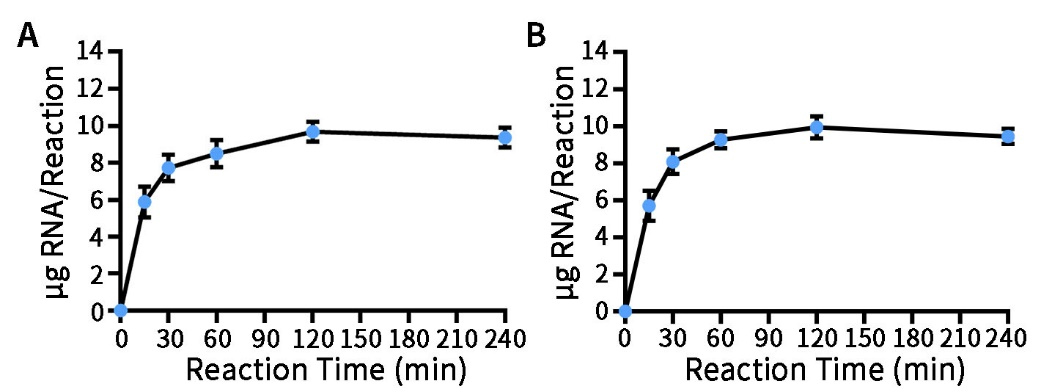
图1.RNA生物素标记试剂盒的产量参考图。带有SP6 Promoter的线性化质粒DNA模板在SP6 RNA Polymerase作用下进行的转录(图A);带有T7 Promoter的线性化质粒DNA模板在T7 RNA Polymerase作用下进行的转录(图B)。在20μL反应体系中,通过使用1.0μg 3199bp的线性化质粒DNA为模板,在37℃分别孵育0、15、30、60、120、240分钟,随后70℃孵育10分钟终止反应;加入2μL DNase I,RNase-free (1U/μL),37℃孵育30分钟消化模板DNA,得到生物素标记的RNA转录产物长度为496nt;用苯酚/氯仿抽提以及乙醇沉淀并用超微量紫外分光光度计检测得到的RNA产物量。实际产量会因具体实验条件的不同而产生差异,本图仅供参考。 - RNA生物素标记试剂盒转录合成生物素标记的RNA探针的检测效果图。
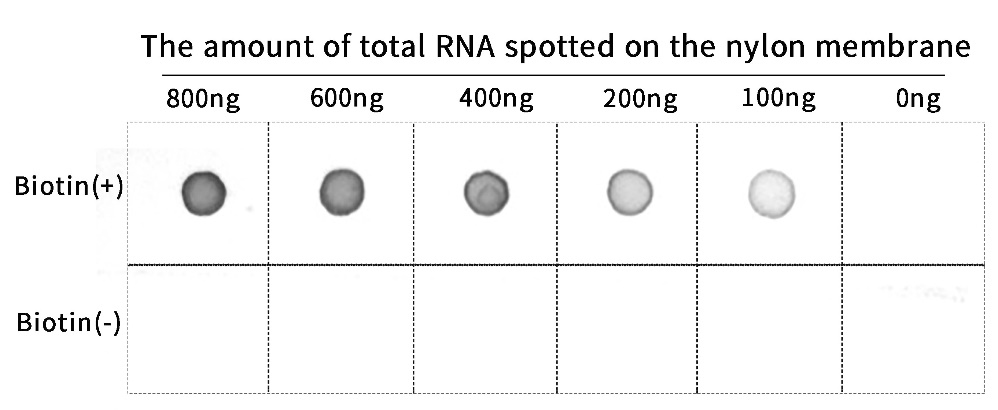
图2.在20μL反应体系中,通过使用1.0μg 3199bp的线性化质粒DNA为模板,在37℃孵育2小时;随后加入2μL DNase I (1U/μL),37℃孵育30分钟消化模板DNA,得到生物素修饰的RNA转录产物;用苯酚/氯仿抽提以及乙醇沉淀纯化RNA产物,用超微量紫外分光光度计检测得到的RNA产物浓度。取适量体积的反应产物(样品中RNA含量分别为800、600、400、200和100ng)滴至尼龙膜上,待样品风干后,进行紫外交联;用Wash Buffer (0.1% Tween-20 in 1×PBS)洗涤3分钟,洗去未结合至膜上的RNA,再用Blocking Buffer (5% Non-fat milk in Wash Buffer)室温封闭1小时。将膜转移至碱性磷酸酶标记链霉亲和素的稀释液中,室温孵育2小时(或4℃孵育过夜);孵育结束后用Wash Buffer室温洗涤3~5次,每次5分钟;随后将洗涤过的尼龙膜浸泡在BCIP/NBT碱性磷酸酯酶染色工作液中,室温避光孵育3~5分钟,直至显色至预期深浅;用蒸馏水室温洗涤1~2次,每次5分钟,终止显色反应,最后使用化学发光成像系统记录化学发光效果。实验结果显示,与未进行生物素标记的RNA探针相比,使用本试剂盒生成的RNA探针能明显检测到生物素的存在,表明生物素成功标记在RNA上。图中检测效果仅供参考,不同的实验条件获得的检测效果可能会略有不同。

- DNA模板的准备:
本试剂盒体外转录的DNA模板需要使用带有SP6或T7 Promoter的线性化质粒DNA、PCR产物或合成的DNA片段等;正义或反义RNA的合成取决于插入序列的方向。将靶序列置于Promoter的下游,在转录时将以双链DNA的反义链为模板转录获得正义RNA,即转录获得的RNA的序列对应于插入的DNA片段的正义链(参考图3)。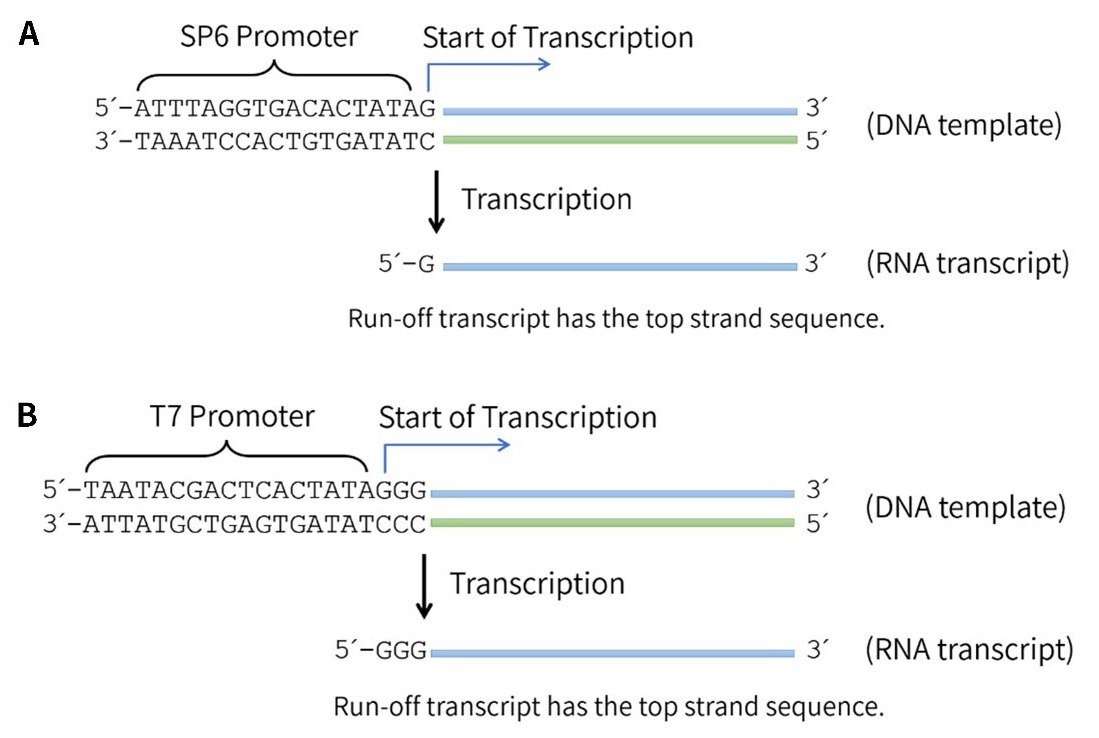
图3.RNA生物素标记试剂盒转录反应示意图。SP6 RNA Polymerase催化的基于SP6 Promoter的RNA转录反应(图A);T7 RNA Polymerase催化的基于T7 Promoter的RNA转录反应(图B)。- 质粒DNA模板的准备:
携带SP6或T7 Promoter的线性化质粒可以作为转录模板。抽提获得高纯度质粒DNA后,用适当的内切酶消化过夜,然后进行DNA柱纯化或苯酚/氯仿抽提和乙醇沉淀。在质粒DNA内切酶消化过夜后进行DNA凝胶电泳和切胶回收线性化质粒DNA的效果通常是比较理想的选择。确保获得线性质粒DNA的更有效方式是,在酶切位点处插入一段比较大的DNA片段,后续双酶切去除该大片段,同时确保酶切后的位点刚好在所需位点处,这样后续通过凝胶电泳很容易回收获得高纯度的线性化质粒DNA模板。- 质粒的线性化程度和纯度都会影响RNA转录产物的产量以及完整性。
- 为了产生确定长度的RNA转录产物,质粒DNA需要通过限制性内切酶消化在待转录插入片段的下游进行线性化处理。线性化质粒DNA作为模板时要尽量确保是平末端或5'端突出(5'overhang),尽量避免3'端突出(3'overhang)。如果出现3'端突出的情况,模板DNA需要用Klenow片段或T4 DNA Polymerase处理成平末端后再进行转录反应或者需要重新设计质粒线性化的酶切位点。
- 由于SP6/T7 RNA Polymerase的高聚合力,与线性DNA模板相比,环状质粒模板会产生更长的异质化的RNA转录产物。因此,重要的是要把环状质粒充分线性化或者线性化后进行凝胶电泳和胶回收以获得高纯度的线性化DNA模板,从而确保转录产物长度和预期的完全一致。
- 以线性化质粒DNA作为模板时,每个20μL反应体系建议使用1μg的线性化质粒DNA。质粒线性化后,需要纯化后再作为体外转录的模板,这样可以避免酶、蛋白、盐等的残留对转录体系的影响。
- 质粒的线性化程度和纯度都会影响RNA转录产物的产量以及完整性。
- PCR产物模板的准备:
携带SP6或T7 Promoter的PCR产物也可以作为本试剂盒用于体外转录的模板。在PCR扩增模板时将SP6 Promoter (ATTTAGGTGACACTATAG)或T7 Promoter (TAATACGACTCACTATAGGG)加在上游引物的5'端。转录前,建议对PCR产物进行琼脂糖凝胶电泳,以评估PCR反应的特异性和产量;尽管可以直接使用PCR产物作为模板,但使用纯化的PCR产物往往可获得更高的产量;根据PCR产物长度的不同,在20μL体外转录反应中可以使用0.1~0.5μg PCR产物。 - 合成的DNA模板:
合成的带有SP6/T7 Promoter的双链(通常通过退火反应获得)可以作为体外转录的模板,或者合成的仅SP6/T7 Promoter为双链而其余的反义链为单链的DNA片段也可以作为体外转录的模板。
- 质粒DNA模板的准备:
- 生物素标记RNA的合成:
- 解冻必要的试剂盒组分,混匀后快速离心一下,将溶液沉淀至离心管底部。如果需进行多个反应,除模板外可以进行预混和再分装到各个反应管内,同时在配制预混液时需要注意把RNA Polymerase在其它组分混合后再最后加入。反应体系通常为20μL,但可以根据需要按比例扩大反应体系。
- 参考下表设置反应体系:混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育2小时。
成分 用量 终浓度 Nuclease-free Water (13.5-x)μL - 10×Transcription Buffer 2μL 1× 10×NTP Labeling Mix 2μL 1× Template DNA xμL 1μg RNase Inhibitor 0.5μL 1U/μL SP6/T7 RNA Polymerase(20U/μL) 2μL 2U/μL 总体积 20μL - - 在标准的RNA聚合酶反应中,1μg线性化DNA模板(约3kb)能够合成8~10μg生物素标记的RNA (约500nt)。通过放大反应组分,可以获得更多的生物素标记的RNA。
- 合成的标记RNA的产量取决于模板DNA的数量、纯度和转录产物的长度。
- 通常37℃孵育2小时就可以获得接近最大的产量。延长孵育时间不会显著增加标记RNA的产量。
- 标记的探针可以立即使用或保存备用,-20℃可以短期保存,推荐在-80℃冻存,并须尽量避免反复冻融。
- 在标准的RNA聚合酶反应中,1μg线性化DNA模板(约3kb)能够合成8~10μg生物素标记的RNA (约500nt)。通过放大反应组分,可以获得更多的生物素标记的RNA。
- (可选) DNase处理去除DNA模板:20μL反应体系中加入2μL RNase-free DNase I(1U/μL),混匀后快速离心一下,将溶液沉淀至离心管底部。37℃孵育30分钟,若出现模板未消化完全的现象,可根据情况适当延长消化时间。
- 当生物素标记的RNA被用于与Northern blots或Southern blots杂交时,可以不进行本操作,因为生物素标记的RNA转录物的数量远远超过模板DNA。
- 终止转录反应:在转录体系中加入适量0.5M EDTA溶液(pH8.0)以停止反应。
- 解冻必要的试剂盒组分,混匀后快速离心一下,将溶液沉淀至离心管底部。如果需进行多个反应,除模板外可以进行预混和再分装到各个反应管内,同时在配制预混液时需要注意把RNA Polymerase在其它组分混合后再最后加入。反应体系通常为20μL,但可以根据需要按比例扩大反应体系。
- RNA产物的纯化:
通常情况下,RNA转录产物可以通过苯酚/氯仿抽提和乙醇沉淀或使用柱纯化的方法进行纯化;对于需要精确控制转录产物长度的情况,建议使用凝胶电泳和切胶回收纯化的方法。- 苯酚/氯仿抽提和乙醇沉淀:
苯酚/氯仿提取和乙醇沉淀RNA转录产物通常是实验室常规操作去除蛋白质和大多数游离核苷酸的首选方法。- 加入160μL Nuclease-free Water将反应体积放大到180μL,再加入20μL 3M醋酸钠(pH5.2)或20μL 5M醋酸铵,充分混匀。加入等体积的苯酚/氯仿混合液(1:1)抽提一次(剧烈Vortex 20~30秒,随后14000×g离心5~10分钟取上清),再用氯仿抽提1~2次(每次剧烈Vortex 20~30秒,随后14000×g离心5~10分钟取上清)。
- 用双倍体积的无水乙醇沉淀RNA,在-20℃至少孵育30分钟。随后14000×g 4℃离心5~10分钟沉淀RNA。
- 弃上清,用约500μL预冷的70%乙醇洗涤沉淀。
- 用50μL DEPC水或0.1mM EDTA重悬并溶解RNA,在-80℃储存。
- 加入160μL Nuclease-free Water将反应体积放大到180μL,再加入20μL 3M醋酸钠(pH5.2)或20μL 5M醋酸铵,充分混匀。加入等体积的苯酚/氯仿混合液(1:1)抽提一次(剧烈Vortex 20~30秒,随后14000×g离心5~10分钟取上清),再用氯仿抽提1~2次(每次剧烈Vortex 20~30秒,随后14000×g离心5~10分钟取上清)。
- 磁珠法纯化:
磁珠法纯化相对操作比较简单,也无需离心操作。推荐使用BalbMag RNA纯化磁珠(货号:YTB4365)进行生物素标记探针的纯化。使用本方法进行纯化时,如果之前没有使用DNase I进行消化,那么就需要充分变性后确保RNA和DNA不形成杂合链的情况下,才能有效去除其中的DNA模板。如果希望去除DNA模板,更推荐使用DNase I消化,因为变性方法很难确保磁珠法纯化时没有杂合链。 - 柱纯化法:
柱纯化可以去除游离的核苷酸、蛋白及盐。
纯化时加入80μL Nuclease-free Water将反应体系补足至100μL,混匀。由于RNA产量较高,为了避免超过离心柱式RNA纯化柱的结合能力,需要对纯化柱的载量进行评估,再根据相应的产品说明书纯化RNA。使用本方法进行纯化时,如果之前没有使用DNase I进行消化,那么就需要充分变性后确保RNA和DNA不形成杂合链的情况下,才能有效去除其中的DNA模板。如果希望去除DNA模板,更推荐使用DNase I消化,因为变性方法很难确保本方法纯化时没有杂合链。 - 凝胶回收纯化法:
当需要高纯度和特定长度的RNA转录产物时,建议凝胶电泳后切胶回收纯化。凝胶电泳可以根据转录产物的长度选择琼脂糖凝胶和聚丙烯酰胺凝胶。
- 苯酚/氯仿抽提和乙醇沉淀:
- RNA转录产物的分析和检测:
- 紫外吸收定量分析:
通过测定A260计算体外转录获得的RNA的量,通过A260/280和A260/A230来判断获得的RNA的纯度。对于单链RNA,1OD对应的RNA浓度为40μg/mL。 - 转录产物的凝胶电泳分析:
为了评估转录产物的长度,完整性和产量,可以使用适当的变性琼脂糖凝胶或变性聚丙烯酰胺凝胶进行电泳分析。大于200nt的转录产物可以使用变性琼脂糖凝胶进行电泳分析。小于200nt的转录产物可以使用变性聚丙烯酰胺凝胶(5~15%)进行电泳分析。凝胶电泳都应在变性条件下进行,以最大程度地减少RNA二级结构对电泳迁移率的影响。- 变性凝胶的制备
① 例如1%变性琼脂糖凝胶的配制:称取1g琼脂糖加入72mL Nuclease-free Water中,加热溶化后,加入10mL 10×MOPS Buffer。待琼脂糖冷却至50~60℃,在通风橱中加入18mL甲醛(37%),混合均匀,倒胶。10×MOPS Buffer:0.4M MOPS (pH7.0),0.1M Sodium Acetate,10mM EDTA。
② 例如15%变性PAGE/尿素凝胶的配制:称取4.2g尿素溶于4.4mL Nuclease-free Water中,使尿素完全溶解。随后加入1.5mL 40% Acr/Bis Solution (丙烯酰胺:甲叉双丙烯酰胺=19:1)和1mL 10×TBE Buffer。使用前,加入100μL 10% APS (过硫酸铵)和10μL TEMED,补足Nuclease-free Water至终体积为10mL。混合均匀,倒胶。10×TBE Buffer:0.9M Tris Base,0.9M Boric Acid,20mM EDTA。 - RNA的凝胶电泳
① 将0.2~1μg RNA样品与2×RNA上样缓冲液混合。
② 通过在65~70℃下加热5~10分钟使RNA样品和RNA Marker样品变性。
③ 在上样之前适当混匀后快速离心一下,以把液体收集到管底。
④ 通过用NadRed、NadGreen或NadGreen plus等核酸染料对凝胶染色后,使用凝胶成像系统进行拍照观察。
- 变性凝胶的制备
- RNA产物的检测:
本试剂盒转录合成的带生物素标记的RNA探针可以使用荧光基团、酶或抗体偶联的链霉亲和素(Streptavidin)进行检测。推荐使用辣根过氧化物酶标记Streptavidin (YT371或YTC0305)与DAB-HRP显色试剂盒或极超灵敏ECL化学发光试剂盒联合使用进行检测,或者使用碱性磷酸酶标记链霉亲和素与BCIP/NBT碱性磷酸酶显色试剂盒联合使用进行检测。具体操作请参考相关产品说明书。
- 紫外吸收定量分析:

- 长链RNA转录产物的产量明显偏低。
如果转录产物是长链RNA (>0.3kb),但其产量明显低于预期,则可能是DNA模板里包含的污染物抑制了RNA Polymerase的活性,或是DNA模板的浓度不正确。建议对模板的浓度以及完整性进行确定,可用苯酚/氯仿对模板进行抽提,并确保把残留的苯酚去除干净。此外,使用的线性化DNA模板需要确保不会产生3'突出的末端,这很可能会导致转录产物的产量明显降低。 - 短链转录产物产量明显偏低。
短链转录产物(<0.3kb)可以通过增加孵育时间和增加模板的量来提高产量。反应时间可以延长至16小时(过夜)或者使用2μg以上的模板将会有助于获得更多的转录产物。此外,线性化使用的内切酶需要确保不会产生3'突出的末端,这样很可能会导致转录产物的产量明显降低。 - RNA转录产物出现明显降解。
如果RNA在变性的琼脂糖凝胶或聚丙烯酰胺凝胶电泳时发现有明显的降解现象,提示DNA模板或操作过程中可能被RNase污染了。被RNase污染的DNA模板会影响合成的RNA的长度和产量,导致长度变短和产量下降。如果模板DNA被RNase污染,需要对模板DNA进行苯酚/氯仿抽提,然后用乙醇沉淀,最后将DNA溶解于Nuclease-free Water中。同时操作过程中需要严格按照RNA的操作要求进行,避免RNase污染。个别情况下会出现DNA模板降解,此时需要通过电泳分析排除相应的可能性。 - 出现比预期更长的RNA转录产物。
如果在变性凝胶中出现比预期更长的RNA转录产物,很可能是质粒DNA模板未被完全线性化。即使是很小量的未被充分消化的环状质粒,也能产生大量的长转录产物。转录反应前需检查模板DNA是否被充分线性化,如果确认含未线性化的质粒,需要再次进行限制性内切酶消化直至充分线性化,或者进行凝胶电泳切胶回收线性化的模板DNA。当RNA转录产物由于存在较强的二级结构而变性不充分时,也可能观察到较大的条带。 - 出现比预期更短的RNA转录产物。
如果在变性凝胶电泳时观察到比预期更短的RNA转录产物,可能是由于RNA转录酶过早终止。一些类似于RNA Polymerase终止信号的序列会导致RNA转录反应的提前终止。可以通过降低转录温度(如30℃)以增加长转录产物的比例,但总产量会降低。对于富含GC或有二级结构的模板,在42℃下孵育会增加长转录产物的产量。当RNA转录产物由于存在较强的二级结构而变性不充分时,也可能观察到较短的条带。
相关搜索:RNA生物素标记试剂盒,生物素标记RNA,RNA体外转录,SP6体外转录,生物素RNA探针合成,Biotin RNA Labeling Kit(SP6/T7)



